第一节 免疫应答的概念与过程
一、免疫应答的概念
抗原性物质进入机体后激发免疫细胞活化,分化和效应过程称之为免疫应答(immuneresponse)。但对这一过程的认识是随着免疫学的发展逐步深化和建立较为完整的概念。在免疫学发展的早期,人们发现抗原性物质进入体内后可在血液中检测出抗体,而对抗原是不产生应答的,其指导学说为侧链学说和指令学说。
进入近代免疫学时期,已知淋巴细胞可能是抗体产生细胞,但尚无直接证明,实验认为抗原只对抗体产生细胞起选择激发作用,并且认为抗体只是由单一淋巴细胞克隆完成的,彼此无关联。在这一时期已证明除存在体液免疫外,还存在有细胞免疫。对“自己”抗原提出了自身耐受的概念,在打破自身耐受的条件下可以发生自身免疫现象,并证明在自身免疫性疾病患者血清中有自身抗体存在。这一时期的指导学说是由Burnet提出的细胞系或克隆选择学说。
进入现代免疫学时期,已证明在高等动物和人体内存在有结构复杂的免疫系统,是由免疫器官、免疫细胞和免疫分子组成的。同时也证明了免疫应答是由多细胞系完成的。并认为它们之间存在着相互协同的和相互制约的关系,在正常免疫生理条件下,它们处于动态平衡,借以维持机体的免疫稳定状态。抗原进入可激发免疫系统打破了这种平衡,从而诱发了免疫应答,再建立新的平衡状态。在此时期还证明了自身耐受是由多种机制形成的,存在着生理性“自身识别”与病理性“自身识别”。其指导学说是由Jerne提出的免疫网络学说。
二、免疫应答的过程
现代免疫学的发展,为了解免疫应答过程提供了细胞学基础。虽然免疫应答过程的效应表现,主要是以B细胞介导的体液免疫和以T细胞介导的细胞免疫。但体内和体外的实验已证明,这二种免疫应答的产生都是由多细胞系完成的,即由单核吞噬细胞系、T细胞和B细胞来完成的。所以免疫应答过程不是单一细胞系的行为,而是多细胞系相互作用的复杂行为。这一过程包括:①免疫细胞对抗原分子的识别过程,即抗原分子与免疫细胞的相互作用;②免疫细胞的活化和分化过程,即免疫细胞间的相互作用;③效应细胞和效应分子的排异作用。(表11-1)。
表11-1 免疫应答过程
识别 |
活化与分化 |
效应 |
抗原的摄取、处理和加工抗原的呈递抗原的识别 |
膜受体的交联 膜信号的产生与传递 细胞增殖与分化 生物活性介质的合成与释放 |
对靶细胞或分子的排异作用 引起组织的损作用(炎症) 免疫应答的调节作用 |
抗原→ Mφ T B |
T与B细胞的境殖与分化 抗体的产生与释放 细胞因子的产生与释放 效应T细胞的产生 免疫记忆细胞的产生 |
抗体分子 效应T细胞 免疫增强系统 补体分子 细胞因子 K/NK细胞 Mφ粒细胞系 肥大细胞 红细胞 血小板 |
排异 或排已 |
免疫保护 免疫病理 |
抗感染 抗肿瘤 自身免疫 变态反应 移植排斥 移植物抗 宿主反应 |
对免疫应答过程的了解,就是要对上述过程进行深入的探讨。现已主证明免疫细胞间的相互作用,既表现相互协同又表现相互拮抗,同时细胞间的相互作用是由其分泌的介质完成的。近年来的实验又证明,免疫细胞在其相互作用中,可表现为具有组织相容性基因的限制性,即所谓MHC限制性,表明免疫细胞的活动是受遗传控制的。上述发现,既揭示了免疫应答过程的复杂性,又反映了它是严密控制和精细的调节过程,这对保持机体自身免疫稳定性是十分重要的。因此,目前对免疫应答机制的研究,已由细胞水平、分子水平进入了基因水平,虽然如此,对这一复杂过程的认识是极其有限的,众多的问题还有待解决。
1.抗原识别阶段此阶段可包括抗原的摄取、处理和加工,抗原的呈递和对抗原的识别,分别由Mφ、T和B细胞完成。
2.免疫细胞的活化和分化阶段此阶段可包括抗原识别细胞膜受体的交联、膜信号产生与传递、细胞增殖与分化以及生物活性介质的合成与释放,主要由T和B细胞完成。
3.免疫应答的效应阶段此阶段主要包括效应分子(体液免疫)和效应细胞(细胞免疫)对非已细胞或分子的清除作用,即所谓排异效应,及其对免疫应答的调节作用。此阶段除抗体和效应T细胞参予外,即非特异免疫细胞和分子参加才能完成排异和免疫调节作用。
第二节 抗体产生的细胞学基础
一、抗体产生的一般规律
当第一次用适量抗原给动物免疫,需经一定潜伏期才能在血液中出现抗体,含量低,且维持时间短,很快下降,称这种现象为初次免疫应答。若在抗体下降期再次给以相同抗原免疫时,则发现抗体出现的潜伏期较初次应答明显缩短,抗体含量也随之上升,而且维持时间长,称这种现象为现次免疫应答或回忆应答。由于对抗体分子结构研究的进展,发现初次应答产生的抗体主要是IgM分子,对抗原结合力低,为低亲和性抗体。而再次应答则主要为IgG分子,且为高亲和性抗体。TD抗原可引起再次应答,而TI抗原只能引起初应答。对初次和再次应答现象机制的研究,对抗体特异性、多样性、免疫记忆以及对自身抗原而受性机制等问题的研究,都必须以抗体生成的细胞学为基础(图11-1,表11-2)。
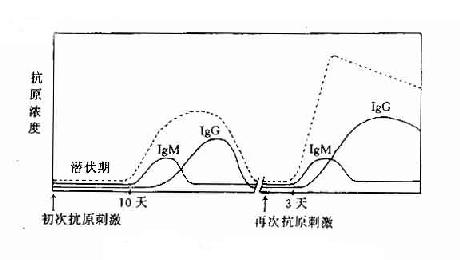
图11-1初次及再次免疫应答
表11-2 初次与再次免疫应答特性
特性 |
初次 |
再次 |
抗原呈递 |
非B细胞 |
B细胞 |
抗原浓度 |
高 |
低 |
抗体产生 |
|
|
延迟相 |
5~10天 |
2~5天 |
Ig类别 |
主要为IgM |
IgG、IgA等 |
亲和力 |
低 |
高 |
无关抗体 |
多 |
少 |
二、抗体产生的细胞学基础
抗体产生是由多细胞完成的,Miller等在60年代,首先证明了淋巴细胞是不均一的细胞群。他用早期摘除鸡的胸腺和法氏囊的方法证明了有二类不同的的淋巴细胞,即T和B细胞。前者与细胞免疫有关,后者与抗体形成有关(表11-3)。
表11-3 新生期摘除胸腺及法氏囊对免疫功能的影响(鸡)
全身X-线照射 |
周围血淋巴细胞数 |
Ig浓度 |
抗体产生 |
移植物排斥反应 |
未身X-线照射 |
148 000 |
++ |
+++ |
++ |
胸腺摘除 |
9 000 |
++ |
+ |
- |
法氏囊摘除 |
13 200 |
- |
- |
+ |
+阳性反应;-阴性反应
Claman 给经X-线照射小鼠移入同系骨髓细胞(B细胞来源)和胸腺细胞(T细胞来源),然后用羊红细胞免疫,结果证明只有同时移入两种细胞才能产生抗体。因此证明了抗体产生需要T和B细胞共同参予。
Unanue等在70年代又证明了巨噬细胞在抗体形成中的重要作用。他们应用纯化细胞的体外培养技术研究这一问题。根据小鼠细胞对玻璃面或塑料面的粘附性,可将脾细胞分为二种,其一为有粘附性细胞属巨噬细胞(Mφ),另一种为非粘附性细胞属淋巴细胞,包括T和B细胞。当将这二种细胞分别与羊红细胞(抗原)在体外培养时,皆不能产生抗体,只有在二种细胞混合培养时才能产生抗体,自此证明了Mφ也参予抗体的产生(表11-4,5)。
表11-4 T和B细胞在抗体产生中的作用
X-线照射鼠入的细胞 |
抗体产生 |
脾细胞(含有T和B) |
++ |
胸腺细胞(T细胞) |
± |
骨髓细胞(B细胞) |
+ |
胸腺细胞+骨髓细胞 |
+++ |
表11-5 Mφ在抗体产生中的作用
体外培养细胞 |
抗体产生 |
粘附细胞+羊红细胞 非粘附细胞+羊红细胞 粘附细胞 + +羊红细胞 非粘附细胞 |
- - +++ |
表11-6 促进B细胞增殖和分化的细胞因子
名称 |
作用 |
IL-1 IL-4 IL-5 IL-6 IL-2 |
促进B细胞活化与增殖 促进活化B细胞增殖 促进B细胞分化 与IL-1协同 |
在同一时期Gershon等又证明了抑制性T细胞(TS)的存在,对免疫应答起抑制作用。因此TH和TS可视为免疫调节细胞,而TC和TD可视为细胞免疫的效应细胞。通过上述研究,证明了抗体产生需要三种细胞参予,即单核吞噬细胞系、T细胞系和B细胞系。从而否定了过去认为抗体产生是由单一淋巴细胞克隆产生的观点。因此抗体产生不只是涉及抗原与免疫细胞间的相互作用,即对抗原的识别和抗原的激发作用,同时也涉及免疫细胞间的相互作用,,即免疫细胞活化,增殖与分化过程。这二个过程是紧密交织在一起的,为此必须进一步探讨在免疫应答过程中,三种细胞各自发挥什么作用?以及它们之间的相互作用又是怎样进行的。
三、免疫细胞在抗体生成中的作用
上述三类细胞都参予抗体生成过程,但各自发挥的作用不同。现已证明Mφ抗原处理和呈递细胞,无特异识别抗原的功能。T细胞系主要是TH和TS,它们对免疫应答有调节功能,所以是免疫调节细胞,有特异识别抗原的功能。B细胞系既具有呈递抗原的作用又是产生抗体的细胞,也具有特异识别抗原的功能。
(一)Mφ的作用
Mφ在免疫应答的全过程都发挥重要作用,在抗原识别过程中,即在免疫应答的诱导期,它表现为具有摄取、处理加工、存贮和呈递抗原的作用。它活化后还能分泌多种细胞因子,其合成和分泌的IL-1有促进T和B细胞的活化作用。因此,不能认为Mφ只是机械的将抗原决定簇呈递给淋巴细胞,它还具有调节淋巴细胞功能的作用。
抗原性物质进入体内后,必须先经Mφ摄取、加工处理,然后才能呈递给淋巴细胞。Mφ是有吞噬细胞功能的细胞,已证明在其细胞表面有多种受体分子,但无抗原识别受体。它主要是以吞噬、吞饮和被动吸附等方式捕捉抗原,可摄取任何抗原性特质,所以是非特异性的摄取抗原性物质。
摄入的抗原大分子,可在细胞内被降解为许多小肽片段。其中一些免疫原性决定簇可与细胞内的自己MHCⅡ类分子相结合,然后运送至细胞膜表面,形成所谓修饰的自身复合物分子(即异种抗原X+自己MHCⅡ类分子)此即Mφ对抗原的处理和加工过程。
Mφ将这种复合物分子,呈递给有抗原识别功能的淋巴细胞,才能激发免疫应答。不难看出,识别这种复合物的抗原识别受体,必须是既能识别异种抗原X,又能同时识别自已MHC分子。这就是免疫细胞间相互作用的MHC限制性的由来。
(二)淋巴细胞的作用
淋巴细胞具有抗原识别受体,所以T和B细胞都是抗原识别细胞。每一细胞克隆可识别一种抗原决定簇,所以这种识别是有特异性的。B细胞表面抗原识别受体是膜Ig分子,它可识别天然蛋白质抗原分子表面的构像抗原决定簇(即B决定簇),在识别抗原时无MHc 限制性。而T细胞抗原识别受体为异二聚体分子,即TCRαβ,它能同时识别经加工处理的序列决定簇肽片段(即T决定簇)和自己MHC分子,所以有MHC限制性。
四、细胞因子在抗体产生中的作用
细胞因子(cytokines)在抗体产生应答过程中的作用有下述特点:
1.细胞因子的作用既无抗原特异性也无MHC限制性当TH细胞受刺激活化后,它所分泌的细胞因子就可作用于任何抗原特异性的B细胞和任何MHC单倍型(haplotype)的B细胞。
2.在B细胞产生免疫应答的不同时期有不同的细胞因子起作用即B细胞的增殖期与分化期,或Ig的分泌期可有不同的细胞因子在起作用(表11-6)。此外,不同的细胞因子间的组合有的起拮抗作用,有的起协同作用。
3.细胞因子还可作用于旁路(bystander)B细胞使之活化这些B细胞对抗体应答的抗原没有特异性(非抗原特异性B细胞)。它们存在于抗原刺激的特异B细胞周围,在抗原活化特异B细胞时,因产生细胞因子而被活化并产生非特异抗体。
4.在刺激B细胞增殖分化的细胞因子中,有些是来源于巨噬细胞或其他非T细胞所产生(如粒细胞、肥大细胞等)。
第三节 抗体形成过程中免疫细胞间的相互作用
在抗体生成过程中,对TD抗原的应答已证明是由Mφ、T系细胞和B系细胞相互作用的结果,那么Mφ直接呈递抗原的对象是T细胞还是B细胞?或者二者都是?就现有资料分析,它们可能存在着Mφ与T的相互作用,T与B的相互作用以及Mφ与B细胞之间的相互作用。
一、巨噬细胞与TH细胞之间的相互作用
TH细胞必须由静止状态的TH转变活化为TH才能辅助B细胞产生抗体。关于TH细胞活化的机制,根据现有实验资料提出一个双信号假说。
近年的实验证明在抗原呈递细胞(APC)表面至少有二种分子与TH细胞的活化相关。一种是抗原呈递分子,它是由MHC分子组成,它可与外源性或内源性抗原肽片段结合,然后运送至细胞表面并呈递给T细胞,通过TCR/CE3刺激产生第1活化信号。另一种分子即所谓协同刺激分子(costimulating molecules,CM),它是由一组粘附分子组成,它不仅能促进APC与T细胞的直接接触,而且也具有诱导信号传递的功能。这组分子可与T细胞上的协同刺激分子受体(costimulatory moleculesrecptor,CMR)结合,刺激其产生协同激信号,即所谓第2信号。
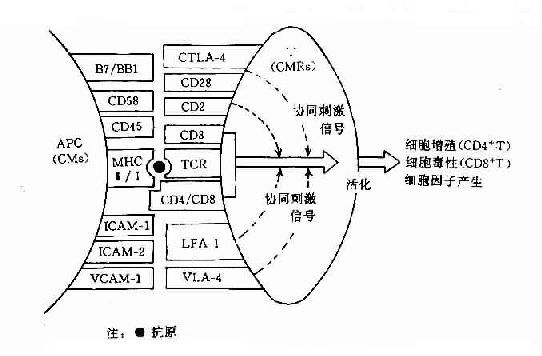
图11-2 T细胞活化主要协同刺激分子(CM)及其受体分子(CMR)的组成和作用示意图
T细胞上的CMR或称为辅助分子(accessory molecules)也是由一组粘附分子组成(表11-7)。对CMR及其配体的分子结构与功能及信号传导途径有待深入研究,但对其中的CD28分子和CTLA-4分子及其配体B7/BB1分子被认为是产生协同刺激信号的主要分子(图11-2)。
在这二种信号的作用下,才能使T细胞活化并合成和分泌IL-2和表达IL-2R,最终导致细胞分裂和克隆扩增。如无第2信号存在则T细胞不被活化也不引起克隆扩增,处于克隆不应答状态(clonol aneergy)(图11-3)。
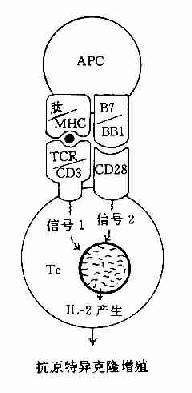
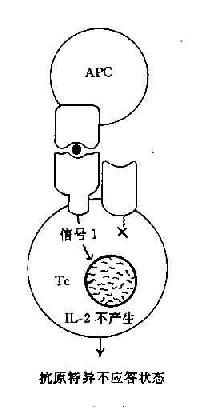
图11-3 协同刺激信号与T细胞活化状态
表11-7 T细胞表面主要辅助分子
名称 |
化学性质 |
基因族 |
细胞分子 |
配体分子(APC) |
功能 |
粘附分子 |
信号传导 |
CD2(LFA-2) |
55kD单体 |
Ig |
成熟T细胞 胸腺细胞 |
CD58(LFA-3) |
+ |
+ |
CD4 |
55kD单体 |
Ig |
CD4+T细胞 |
MHCⅡ分子 |
+ |
+ |
CD8 |
78kD单体 |
Ig |
CD8+T细胞 |
MHCⅡ分子 |
+ |
+ |
CD11a/CD18 (LFA-1) |
180/95kD双体 |
粘合素 |
骨髓衍生细胞 |
CD54(ICAM-1) |
? |
+ |
CD28 |
90kD同二聚体 |
|
CD4+ CD8+T(50%) |
B7/BB1 |
+ |
+ |
CDw49/CD29 (VLA-4、5、6) |
异二聚体 |
粘合素 |
白细胞 其它细胞 |
细胞外基质VCAM-1 |
+ |
+ |
gP39(CD40L) |
|
|
CD4+T细胞 |
CD40 |
|
|
阻断或给予第2信号,可以人为调节免疫应答使之增强或或抑制,对免疫治疗提供了新的手段。如阻断第2信号的产生可使T细胞处于免疫耐受状态,降低机体的免疫应答,这对防止移植排斥的发生和对超敏性疾病以及自身免疫性疾病的治疗是有利的。如将B7基因导入一定的肿瘤细胞则可增强机体的抗肿瘤免疫应答,目前这方面的实验研究已有较多的报道(图11-4)。
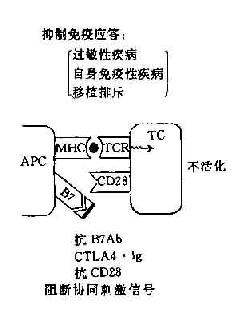
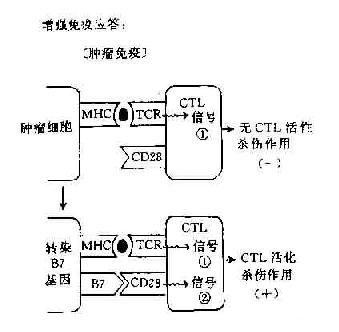
图11-4 协同刺激信号与免疫应答调节
二、TH细胞与B细胞之间的相互作用
(一)B细胞对T细胞依赖抗原的应答
一般情况下当大量抗原进入未经免疫的机体后,诱发初次免疫应答时其抗原呈递细胞多由巨噬细胞完成。经Mφ活化TH细胞后再由活化的TH细胞辅助B细胞产生抗体和形成记忆B细胞。但当再次免疫应答发生时,抗原呈递细胞则主要由已扩增的B细胞克隆承担。由于其膜Ig受体亲和力增高故对少量抗原也能摄取,故可取代巨噬细胞的抗原呈递作用。
过去曾认为B细胞与TH细胞间的相互作用是通过抗原的桥联作用使之发生接触,即B细胞的抗原受体可识别抗原分子的半抗原部分,而TH细胞的抗原受体可识别抗原分子的载体部分。但近年的实验证明B细胞与Mφ相同,也是通过抗原呈递作用与TH细胞相互作用。即B细胞可通过其膜Ig受体蛋白质抗原,即T依赖性抗原结合,经内化作用将抗原摄入。然后经过加工处理,使T细胞决定簇与MHCⅡ类分子结合,形成MHC-肽分子复合物并运送至B细胞表面,将其呈递给TH细胞,所以B细胞与TH细胞间的相互作用也是MHC限制性的。
B细胞和TH细胞通过其粘附分子及抗原呈递作用可彼此直接接触,并能相互诱导使之活化。活化B细胞在TH细胞的辅助下,B细胞最终增殖分化为合成和分泌各类免疫球蛋白分子的浆细胞。
B细胞可通过其抗原呈递作用刺激T细胞抗原受体(TCR/CD3)产生活化信号1,并通过其表面B7及其它协同刺激分子与T细胞表面的相应受体分子如CD28、IFA-1等相结合,可激发产生协同刺激信号(即信号2),在双信号作用下可使TH细胞活化。
B细胞要通过其BCR即表面Ig受体与抗原结合,Iga和Igβ链与CD3分子相当,可传递活化信号1。近年证明在B细胞表面表达的CD40分子可与T细胞表面的相应配体分子gP39(即CD40配体分子,CD40L)结合可激发其产生活化信号2,在此双信号作用下可使B细胞活化(图11-5)。
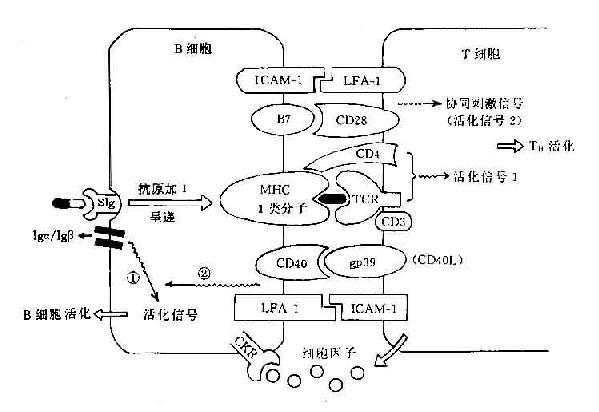
图11-5 B细胞与TH细胞间相互作用
活化的B细胞在活化的TH细胞分泌的多种细胞因子作用下,可增殖分化为分泌抗体的浆细胞和记忆B细胞。在再次应答时可发生Ig类别转换及抗体亲和力成熟等一系列变化。
(二)B细胞对非T细胞依赖抗原的应答
B细胞对非细胞依赖抗原(T1)的活化机制与T细胞依赖抗原完全不同。对Ⅰ型T1抗原,例如细菌脂多糖抗原,在高浓度时,它是B细胞的多克隆活化剂。这类抗原的决定簇部分可与B细胞表面的抗原受体结合,另外它具有促分裂素(mitogen)的结构,可与其相应受体结合。在这两部分结构的结合作用下,使B细胞多克隆活化。
而Ⅱ型T1抗原的结构特点是具有多个重复出现的抗原决定簇呈线性排列,在体内不易降解,例如肺炎球菌等多糖抗原。这些抗原决定簇对B细胞抗原受体亲和力强,由于受体交联而使B细胞活化(图11-6)。
A.Ⅰ型T1抗原是多克隆活化剂 B.Ⅱ型T1抗原有多个重复排的抗原决定簇使受体交联
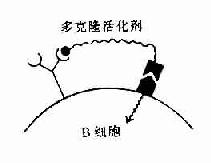
图11-6 T1抗原对B细胞的活化作用
T1抗原虽可被APC摄取,但不能被加工处理,所以不能与MHCⅡ类分子结合,故B细胞对T1抗原的应答无TH细胞参予,只表现初次应答的特性而不出现次应答的一系列变化。
三、巨噬细胞与B细胞的相互作用
这二种细胞间的相互作用尚不能肯定。但由于B细胞在大多数情况下需要有TH的协同,所以B细胞活化至少是间接的需要Mφ对B细胞的活化有直接作用,其分泌的IL-1对B细胞活化有促进作用(图11-7)。
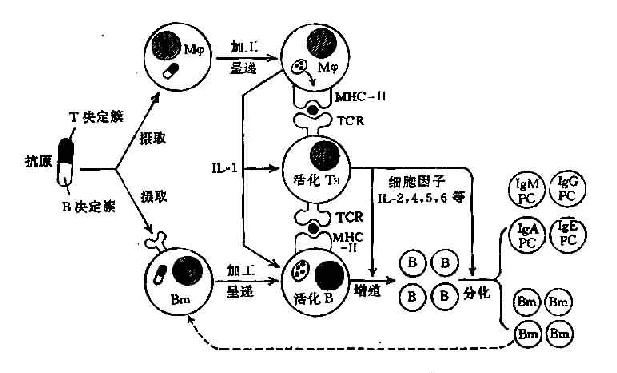
图11-7 抗体产生过程中免疫细胞间相互作用
第四节 免疫记忆
用同一抗原再次免疫时,可引起比初次更强的抗体产生,称之为再次免疫应答或免疫记忆,无论在体液免疫或细胞免疫均可发生免疫记忆现象。在体液免疫时,对TD抗原的再次应答可表现为抗体滴度明显上升,免疫球蛋白类别可由IgM转换为IgG,而且抗体亲和力增强。提示再次应答不仅发生抗体量的变化,而且也发生了质的变化。实验证明,免疫记忆的基础是免疫记忆细胞的产生。
一、免疫记忆细胞
在载体-半抗原效应的研究中,已证明T细胞及B细胞都与免疫记忆有关。即在免疫应答过程中,既能产生B记忆细胞(Bm),也能产生TH记忆(THm)。免疫记忆现象可以解释为对特异抗原应答的淋巴细胞数量增加的现象。
用有限稀释法计数在载体-半抗原效应中免疫记忆细胞的数量变化,发现在T细胞群中对载体特异的T细胞辅助活性比初次应答可增强10倍。这不仅是由于TH细胞数量的增加,也反映了TH功能的增强所致。
有相同方法也证明了在再次应答中对半抗原特异的细胞数量亦增加,由其产生抗体性质的变化,表明B记忆细胞也伴随有质的变化。关于前进B细胞(Bp)、成熟B细胞(Bv)、记忆B细胞(Bm)的特性可见表11-8。
表11-8 Bp、Bv、Bm细胞的特性
|
Bp |
Bv |
Bm |
更新速率 |
快(数日) |
快(数日) |
慢(数月~数周) |
再循环 |
无 |
无 |
有 |
组织分布 |
|
|
|
胚胎期 |
肝、脾 |
- |
- |
成年期 |
骨髓 |
骨髓、脾、淋巴节 |
胸导管、脾、淋巴结 |
耐受性产生 |
易 |
难 |
难 |
对抗原亲和力 |
- |
低 |
高 |
过继抗体产生 |
慢(2~3周) |
快(1~3周) |
快(1周) |
电泳迁移率 |
- |
快 |
慢 |
二、免疫球蛋白类别的转换
在初次应答时开始出现的抗体是IgM,当达到高峰时才开始出现IgG,而IgG高峰虽出现较晚,但能维持较长时间。在再次应答时产生IgG的潜伏期明显缩短,水平更高。
这种由IgM转换为IgG只是Ig分子的类别变化,其识别抗原的特异性则仍相同。表明这二类Ig分子V区结构相同,只是C区结构发生了变化。实验证明,给新生小鼠注入抗μ血清,可抑制IgG和IgM的产生,提示这种转换可能是由产生IgM的细胞变为产生IgG的细胞,而不是由不同亚群的B细胞产生的。
三、抗体亲和力的变化
在抗体生成过程中,抗体分子的平均亲和力随着时间的延长而增加,这种现象称为抗体分子亲和力的成熟。实验证明,在免疫应答过程中,IgG的亲和力可增加达数百倍。这种亲和力的成熟现象,被认为是由于存在具有不同亲和力Ig受体的B细胞。在免疫应答初期可因存在较大量的游离抗原分子,因此与低亲和力受体的B细胞结合较多,故其所产生抗体分子的平均亲和力较低。当抗原量逐渐减少时,则与带有高亲和力受体细胞的结合多于低亲和力受体细胞,因之抗体分子的平均亲和力随时延长而增高。
第五节 体液免疫的效应
免疫应答最终效应是将侵入机体的非已细胞或分子加以清除,即排异效应。但抗体分子本身只具有识别作用。,并不具有杀伤或排异作用,因此体液免疫的最终效应必须借助机体的其它免疫细胞或分子的协同作用才能达到排异的效果。
一、抗体分子的中和作用
由于抗体分子有特异识别作用,它可与侵入机体的病毒或外毒素分子结合,从而阻断了病毒进入细胞的能力或中和了外毒素分子的毒性作用。从而发挥抗体分子的保护作用。
二、抗体分子的调理作用
单核吞噬细胞系统以及中性粒细胞的表面,都带有IgG或IgM分子的Fc受体或补体分子受体。因此,由抗体与抗原形成的免疫复合物极易被这种具有吞噬功能的免疫细胞所吞噬杀伤或降解并被排除。
三、补体介导的细胞溶解作用
补体分子可经第一活化途径或旁路活化途径溶解靶细胞。但补体分子在无抗体分子存时,不能被活化。因此,抗体分子可借补体的作用溶解细胞,被溶解的细胞再经吞噬细胞系统加以排除。
四、抗体依赖细胞介导的细胞毒性作用
凡是具有IgG、Fc段受体的吞噬细胞或具有杀伤活性的细胞都参予这种作用。因此参予抗体依赖细胞介导的细胞毒性作用(ADCC)的细胞可有巨噬细胞、中性粒细胞和杀伤细胞(K细胞)等。
第六节 体液免疫应答的调节
无论体液免疫应答与细胞免疫应答,都不能无限制的发展下去,在免疫系统内存在着复杂的调节机制,以控制免疫应答的发展,这是一种对生理功能的保护作用。
一、抗体的反馈调节
当抗体产生后,可不断与抗原结合,并被清除。这是抗原被清除的原因之一,因此可终止免疫应答发生。
二、免疫抑制细胞的作用
免疫系统内已证明有抑制性细胞存在,特别是抑制性T细胞,即TS细胞,对免疫应答有重要调节作用。当免疫应答发展到一定程度时,即能诱发抑制性T细胞的作用。其作用机制可能是它分泌的特异性抑制性因子(TSF)和它参予的网络调节。
三、免疫网络调节
现已证明每一种特异性抗体分子(Ab1)都具有其独特型决定簇,并具有自己抗原性。当抗体分子产生至一定量时,其独特型决定簇可激发其自体产生抗独特型抗体(Ab2),并可连续发展下去。此种抗独特型抗体可促进或抑制免疫应答。其后证明独特型决定簇除存于B细胞的抗原受体外,也存在于TH和TS细胞的抗原识别受体分子上,因此抗独特型抗体亦可通过TH及TS细胞的作用发挥免疫调节作用。Jerne根据抗独特型诱发的免疫调节作用,于1974年提出了他的独特型免疫网络学说(immune network theory)。

