抗体分子(antibody,Ab)是由浆细胞合成和分泌的,而每一种浆细胞克隆可以产生一种特异的抗体分子,所以血清中的抗体是多种抗体分子的混合物,它们的化学结构是不均一的,而且含量很少,不易纯化,是抗体分子结构分析的困难。
多发性骨髓瘤是由浆细胞无限增殖形成的细胞克隆,由于所有瘤细胞的遗传特性相同,因此它们合成和分泌的蛋白质分子在化学结构上是均一的。这种蛋白分子存在于血液中的称为骨髓瘤蛋白(meyloma protein,M)或M蛋白,亦可在尿液中发现称为本周蛋白(BenceJones,BJ)由于这种蛋白分子含量很高,极易纯化,故为Ig分子结构的展使得对Ig分子结构、理化性质、抗原性、生物学活性以及其基因结构等方面的研究者有了重大突破。
第一节抗体的发现及其特性
一、抗体的发现
在免疫学发展的早期人们应用细菌或其外毒素给动物注射,经一定时期后用体外实验证明在其血清中存在一种能特异中和外毒素毒性的组分称之为抗毒素,或能使细菌发生特异性凝集的组分称之为凝集素。其后将血清中这种具有特异性反应的组分称为抗体(antibody,Ab),而将能刺激机体产生抗体的物质称之为抗原(antigen,Ag)。由此建立了抗原与抗体的概念。
1890年德国学者Behuing和日本学者北里用白喉杆菌外毒的组分称为抗毒素,这是在血清中发现的第一种抗体。这种含有抗体的血清称之为免疫血清。
二、抗体的理化性质
1.抗体是球蛋白 早在40年代初期Tiselius和Kabat就证实了抗体活性与血清丙种球蛋白组分相关。他们用肺炎球菌多糖免疫家兔,可获得高效价免疫血清。然后加入相应抗原吸收以除去抗体,将去除抗体的血清进行电泳图谱分析,发现丙种球蛋白(γ-G)组分明显减少,从而证明了抗体活性是存在于丙种球蛋白内。
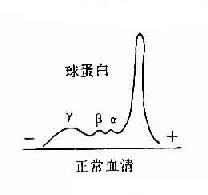
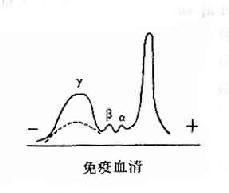
图2-1 兔血清电泳分离图
其后,经对不同免疫血清的电泳分析,超速离心分析和分子量测定等方法,发现大部分抗体活性存在于γ球蛋白内,但有小部分抗体活性可存在于β球蛋白内。它们的离心常数分别为7S和平共处9S,分子量分别为16万和万。因此它们分别被命名为7Sγ球蛋白分子(16万)19S,β2巨球蛋白分子(β2M,90万)和β2A球蛋白分子,所以从早期对抗体性质的研究证明抗体不是由均质性球蛋白组成,而是由异性球蛋白组成。
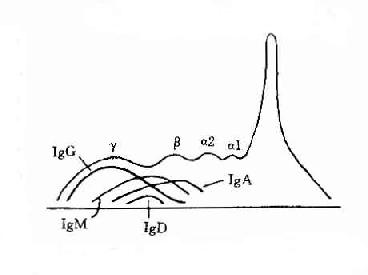
图2-2 不同类免疫球收白的电泳分离图
2.免疫球蛋白为了准确描述抗体蛋白的性质,在60年代初提出将具有抗体活性的球蛋白称为免疫球蛋分子(immunoglobulin,lg)。γ球蛋白则必称为IgG,β2M称为IgM,而β2A称为IgA。其后又相继发现二类Ig分子,分别称为IgE和IgD。故在血清中现已发现有五类免疫球蛋白分子,它们的结构与功能是各不相同的。
三、抗体的生物学活性
1.抗体与抗原的特异性结合刺激抗体产生的物质称为抗原,抗体分子与其相应的抗原发生结合称为特异性结合。例如,白喉抗毒素只能中和白喉杆菌外毒素,而不能中各破伤风外毒素,反之亦然。
2.抗体与补体的结合在一定条件下,抗体分子可以与存在于血清中的补体分子相结合,并使之活化,产生多种生物学效应,称之为抗体的补体结合现象,揭示了抗体分子与补体分子间的相互作用。
3.抗体的调理作用抗体的第三种功能是可增强吞噬细胞的吞噬作用。在体外的实验中,如将免疫血清中加入中性粒细胞的悬液中,可增强对相应细胞的吞噬作用,称这种现象为抗体的调理作用。自此揭示了抗体分子与免疫细胞间的相互作用。为了说明抗体分子这些生物学功能,必须进一步了解抗体分子的结构与功能的关系。
第二节免疫球蛋白分子的结构与功能
一、免疫球蛋白分子的基本结构
Porter等对血清IgG抗体的研究证明,Ig分子的基本结构是由四肽链组成的。即由二条相同的分子量较小的肽链称为轻链和二条相同的分子量较大的肽链称为重链组成的。轻链与重链是由二硫键连接形成一个四肽链分子称为Ig分子的单体,是构成免疫球蛋白分子的基本结构。Ig单体中四条肽链两端游离的氨基或羧基的方向是一致的,分别命名为氨基端(N端)和羧基端(C端)。
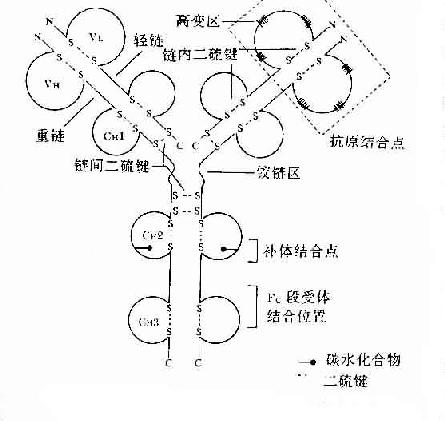
图2-3 免疫球蛋白分子的基本结构示意图
(一)轻链和重链
由于骨髓瘤蛋白(M蛋白)是均一性球蛋白分子,并证明本周蛋白(BJ)是Ig分子的L链,很容易从患者血液和尿液中分离纯化这种蛋白,并可对来自不同患者的标本进行比较分析,从而为Ig分子氨基酸序列分析提供了良好的材料。
1.轻链(lightchain,L) 轻链大约由214个氨基酸残基组成,通常不含碳水化合物,分子量约为24kD。每条轻链含有两个由链内二硫键内二硫所组成的环肽。L链共有两型:kappa(κ)与lambda(λ),同一个天然Ig分子上L链的型总是相同的。正常人血清中的κ:λ约为2:1。
2.重链(heavychain,H链) 重链大小约为轻链的2倍,含450~550个氨基酸残基,分子量约为55或75kD。每条H链含有4~5个链内二硫键所组成的环肽。不同的H链由于氨基酸组成的排列顺序、二硫键的数目和们置、含的种类和数量不同,其抗原性也不相同,根据H链抗原性的差异可将其分为5类:μ链、γ链、α链、δ链和ε链,不同H链与L链(κ或λ链)组成完整Ig的分子分别称之为IgM、IgG、IgA、IgD和IgE。γ、α和δ链上含有4个肽,μ和ε链含有5个环肽。
(二)可变区和恒定区
通过对不同骨髓蛋白或本周蛋白H链或L链的氨基酸序列比较分析,发现其氨基端(N-末端)氨基酸序列变化很大,称此区为可变区(V),而羧基末端(C-末端)则相对稳定,变化很小,称此区为恒定区。
1.可变区(variableregion,V区) 位于L链靠近N端的1/2(约含108~111个氨基酸残基)和H链靠近N端的1/5或1/4(约含118个氨基酸残基)。每个V区中均有一个由链内二硫键连接形成的肽环,每个肽环约含67~75个氨基酸残基。V区氨基酸的组成和排列随抗体结合抗原的特异性不同有较大的变异。由于V区中氨基酸的种类为排列顺序千变万化,故可形成许多种具有不同结合抗原特异性的抗体。
L链和H链的V区分别称为VL和VH。在VL和VH中某些局部区域的氨基酸组成和排列顺序具有更高的变休程度,这些区域称为高变区(hypervariable region,HVR)。在V区中非HVR部位的氨基酸组面和排列相对比较保守,称为骨架区(fuamework rugion)。VL中的高变区有三个,通常分别位于第24~34、50~65、95~102位氨基酸。VL和VH的这三个HVR分别称为HVR1、HVR2和HVR3。经X线结晶衍射的研究分析证明,高变区确实为抗体与抗原结合的位置,因而称为决定簇互补区(complementarity-determining regi-on,CDR)。VL和VH的HVR1、HVR2和HVR3又可分别称为CDR1、CDR2和CDR3,一般的CDR3具有更高的高变程度。高变区也是Ig分子独特型决定簇(idiotypic determinants)主要存在的部位。在大多数情况下H链在与抗原结合中起更重要的作用。
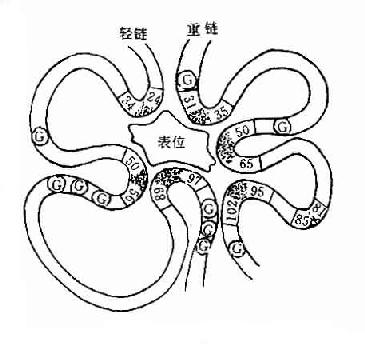
图2-4 与表位结合高变区示意图(G表示相对保守的甘氨酸)
2.恒定区(constantregion,C区) 位于L链靠近C端的1/2(约含105个氨基酸残基)和H链靠近C端的3/4区域或4/5区域(约从119位氨基酸至C末端)。H链每个功能区约含110多个氨基酸残基,含有一个由二锍键连接的50~60个氨基酸残基组成的肽环。这个区域氨基酸的组成和排列在同一种属动物Ig同型L链和同一类H链中都比较恒定,如人抗白喉外毒素IgG与人抗破伤风外毒素的抗毒素IgG,它们的V区不相同,只能与相应的抗原发生特异性的结合,但其C区的结构是相同的,即具有相同的抗原性,应用马抗人IgG第二体(或称抗抗体)均能与这两种抗不同外毒素的抗体(IgG)发生结合反应。这是制备第二抗体,应用荧光、酶、同位毒等标记抗体的重要基础。
(三)功能区
Ig分子的H链与L链可通过链内二硫键折叠成若干球形功能区,每一功能区(domain)约由110个氨基酸组成。在功能区中氨基酸序列有高度同源性。
1.L链功能区分为L链可变区(VL)和L链恒定区(CL)两功能区。
2.H链功能区IgG、IgA和IgD的H链各有一个可变区(VH)和三个恒定区(CH1、CH2和CH3)共四个功能区。IgM和IgE的H链各有一个可变区(VH)和四个恒定区(CH1、CH2、CH3和CH4)共五个功能区。如要表示某一类免疫蛋白H链恒定区,可在C(表示恒定区)后加上相应重链名称(希腊字母)和恒定区的位置(阿拉伯数字),例如IgG重链CH1、CH2和CH3可分别用Cγ1、Cγ2和Cγ3来表示。
IgL链和H链中V区或C区每个功能区各形成一个免疫球蛋白折叠(immunoglobulin fold,Ig fold),每个Ig折叠含有两个大致平行、由二硫连接的β片层结构(betapleated sheets),每个β片层结构由3至5股反平行的多肽链组成。可变区中的高变区在Ig折叠的一侧形成高变区环(hypervariable loops),是与抗原结合的位置。
3.功能区的作用
(1)VL和VH是与抗原结合的部位,其中HVR(CDR)是V区中与抗原决定簇(或表位)互补结合的部位。VH和VL通过非共价相互作用,组成一个FV区。单位Ig分子具有2个抗原结合位点(antigen-bindingsite),二聚体分泌型IgA具有4个抗原结合位点,五聚体IgM可有10个抗原结合位点。
(2)CL和CH上具有部分同种异型的遗传标记。
(3)CH2:IgGCH具有补体Clq结合点,能活化补体的经典活化途径。母体IgG借助CH2部分可通过胎盘主动传递到胎体内。
(4)CH3:IgGCH3具有结合单核细胞、巨噬细胞、粒细胞、B细胞和NK细胞Fc段受体的功能。IgMCH3(或CH3因部分CH4)具有补体结合位点。IgE的Cε2和Cε3功能区与结合肥大细胞和嗜碱性粒细胞FCεRI有关。
4.铰链区(hingeregion)铰链区不是一个独立的功能区,但它与其客观存在功能区有关。铰链区位于CH1和CH2之间。不同H链铰链区含氨基酸数目不等,α1、α2、γ1、γ2和γ4链的铰链区较短,只有10多个氨基酸残基;γ3和δ链的铰链区较长,约含60多个氨基酸残基,其中γ3铰链区含有14个半胱氨酸残基。铰链区包括H链间二硫键,该区富含脯氨酸,不形成α-螺旋,易发生伸展及一定程度的转动,当VL、VH与抗原结合时此氏发生扭曲,使抗体分子上两个抗原结合点更好地与两个抗原决定簇发生互补。由于CH2和CH3构型变化,显示出活化补体、结合组织细胞等生物学活性。铰链区对木瓜蛋白酶、胃蛋白酶敏感,当用这些蛋白酶水解免疫球蛋白分子时常此区发生裂解。IgM和IgE缺乏铰链区。
(四)J链和分泌成分
1.J链(joining chain) 存在于二聚体分泌型IgA和五聚体IgM中。J链分子量约为15kD,由于124个氨基酸组成的酸性糖蛋白,含有8个半胱氨酸残基,通过二硫键连接到μ链或α链的羧基端的半胱氨酸。J链可能在Ig二聚体、五聚体或多聚体的组成以及在体内转运中的具有一定的作用。
2.分泌成分(secretorycomponent,SC)又称分泌片(secretory piece),是分泌型IgA上的一个辅助成分,分子量约为75kD,糖蛋白,由上皮细胞合成,以共价形式结合到Ig分子,并一起被分泌到粘膜表面。SC的存在对于抵抗外分泌液中蛋白水解酶的降解具有重要作用。
(五)单体、双体和五聚体
1.单体 由一对L链和一对H链组成的基本结构,如IgG、IgD、IgE血清型IgA。
2.双体 由J链连接的两个单体,如分泌型IgA(secretory IgA,SIgA)二聚体(或多聚体)IgA结合抗原的亲合力(avidity)要比单体IgA高。
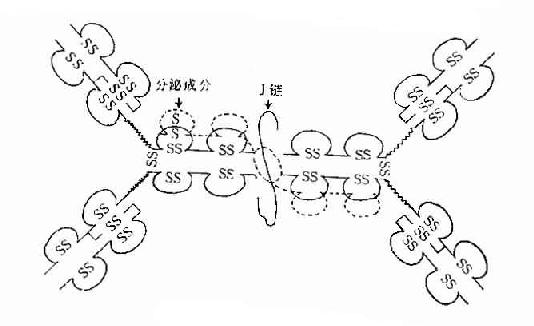
图2-5 分泌型IgA结构示意图
3.五聚体 由J链和二硫键连接五个单体,如IgM。μ链Cys414(Cμ3)和Cys575(C端的尾部)对于IgM的多聚化极为重要。在J链存在下,通过两个邻近单体IgMμ链Cys之间以及J链与邻μ链Cys575之间形成二硫键组成五聚体。由粘膜下浆细胞所合成和分泌的IgM五聚体,与粘膜上皮细胞表面pIgR(poly-Ig receptor,pIgR)结合,穿过粘膜上皮细胞到粘膜表面成为分泌型IgM(secretory IgM)。
(六)酶解片段
1.本瓜蛋白酶的水解片段Porter等最早用木瓜蛋白酶(papain)水解兔IgG,从而区划获知了Ig四肽链的基本结构和功能。
(1)裂解部位:IgG铰链区H链链间二硫键近N端侧切断。
(2)裂解片段:共裂解为三个片段:①两个Fab段(抗原结合段,fragmentof antigen binding),每个Fab段由一条完整的L链和一条约为1/2的H链组成,Fab段分子量为54kD。一个完整的Fab段可与抗原结合,表现为单价,但不能形成凝集或沉淀反应。Fab中约1/2H链部分称为Fd段,约含225个氨基酸残基,包括VH、CH1和部分铰链区。②一个Fc段(可结晶段,fragmentcrystallizable),由连接H链二硫键和近羧基端两条约1/2的H链所组成,分子量约50kD。Ig在异种间免疫所具有的抗原性主要存在于Fc段。
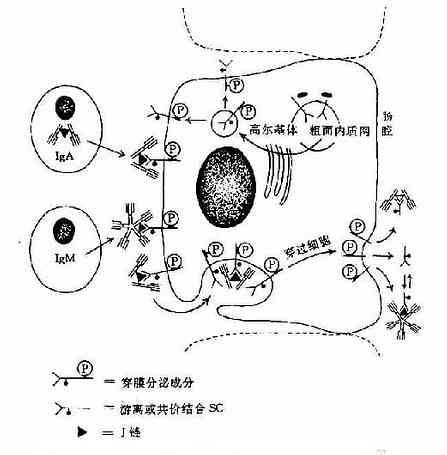
图2-6 人分泌型IgA和分泌型IgM的局部产生示意图
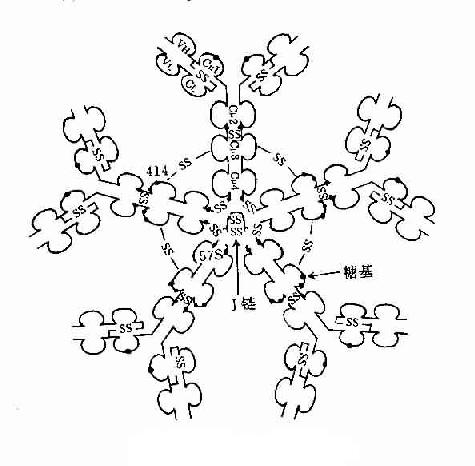
图2-7 IgM结构示意图
2.胃蛋白酶的水解片段Nisonoff等最早用胃蛋白酶(pepsin)裂解免疫球蛋白。
(1)裂解部位:铰链区H链链间二硫键近C端切断。
(2)裂解片段:
1)F(ab')2:包括一对完整的L链和由链间二硫键相连一对略大于Fab中Fd的H链,称为Fd',约含235个氨基酸残基,包括VH、VH1和铰链区。F(ab')2具有双价抗体活性,与抗原结合可发生凝集和沉淀反应。双价的F(ab')2与抗原结合的亲合力要大于单价的Fab。由于应用F(ab')2时保持了结合相应抗原的生物学活性,又减少或避免了Fc段抗原性可能引起的副作用,因而在生物制品中有较大的实际应用价值。虽然F(ab')2与抗原结合特性方面同完整的Ig分子一样,但由于缺乏Ig中部分,因此不具备固定补体以及与细胞膜表面Fc受体结合的功能。F(ab')2经还原等处理后,H链间的二硫可发生断裂而形成两个相同的Fab'片段。
2)Fc'可继续被胃蛋白酶水解成更小的片段,失去其生物学活性。
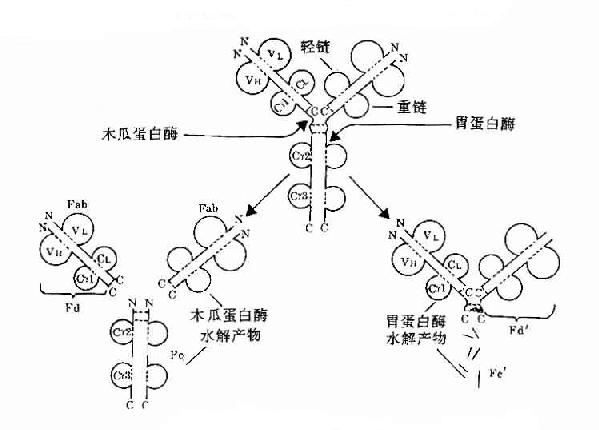
图2-8 Ig酶水解片段示意图
二、免疫球蛋白分子的功能
Ig是体液免疫应答中发挥免疫功能最主要的免疫分子,免疫球蛋白所具有的功能是由其分子中不同功能区的特点所决定的。
(一)特异性结合抗原
Ig最显着的生物学特点是能够特异性地与相应的抗原结合,如细菌、病毒、寄生虫、某些药物或侵入机体的其他异物。Ig的这种特异性结合抗原特性是由其V区(尤其是V区中的高变区)的空间构成所决定的。Ig的抗原结合点由L链和H链超变区组成,与相应抗原上的表位互补,借助静电力、氢键以及范德华力等次级键相结合,这种结合是可逆的,并受到pH、温度和电解浓度的影响。在某些情况下,由于不同抗原分子上有相同的抗原决定簇,或有相似的抗原决定簇,一种抗体可与两种以上的抗原发生反应,此称为交叉反应(cross reaction)。
抗体分子可有单体、双体和五聚体,因此结合抗原决定簇的数目(结合价)也不相同。Fab段为单价,不能产生凝集反应和沉淀反应。F(ab')2和单体Ig(如IgG、IgD、IgE)为双价。双体分泌型IgA有4价。五聚体IgM理论上应为10价,但实际上由于立体构型的空间位阻,一般只有5个结合点可结合抗原。
B细胞表面Ig(SmIg)是特异性识别抗原的受体,成熟B细胞主要表达SmIgM和SmIgD,同一B细胞克隆表达不同类SmIg其识别抗原的特异性是相同的。
(二)活化补体
1.IgM、IgG1、IgG2和IgG3可通过经典途径活化补体。当抗体与相应抗原结合后,IgG的CH2和IgM的CH3暴露出结合C lq的补体结合点,开始活化补体。由于Clq6个亚单位中一般需要2个C端的球与补体结合点结合后才能依次活化Clr和Cls,因此IgG活化补体需要一定的浓度,以保证两个相邻的IgG单体同时与1个Clq分子的两个亚单位结合。当Clq一个C端球部结合IgG时亲和力则很低,Kd为10-4M,当Clq两个或两个以上球部结合两个或多个IgG分时,亲合力增高Kd为10-8M。IgG与Clq结合点位于CH2功能区中最后一个β折叠股318~322位氨基酸残基(Glu-x-Lys-x-Lys)。IgM倍以上。人类天然的抗A和抗B血型抗体为IgM,血型不符合引韦的输血反应发生快而且严重。
2.凝聚的IgA、IgG4和IgE等可通过替代途径活化补体。
(三)结合Fc受体
不同细胞表面具有不同Ig的Fc受体,分别用FcγR、FcεR、FcαR等来表示。当Ig与相应抗原结合后,由于构型的改变,其Fc段可与具有相应受体的细胞结合。IgE抗体由于其Fc段结构特点,可在游离情况下与有相应受体的细胞(如嗜碱性粒细胞、肥大细胞)结合,称为亲细胞抗体(cytophilic antibody)。抗体与Fc受体结合可发挥不同的生物学作用。
1.介导I型变态反应变应原刺激机体产生的IgE可与嗜碱性粒细胞、肥大细胞表面IgE高亲力受体细胞脱颗粒,释放组胺,合成由细胞FcεRI结合。当相同的变应原再次进入机体时,可与已固定在细胞膜上的IgE结合,刺激细胞脱颗粒,释放组受,合成由细胞脂质来源的介质如白三烯、前列腺素、血小板活化因子等,引起Ⅰ型变态反应。
2.调理吞噬作用 调理作用(opsonization)是指抗体、补体C3b、C4b等调理素(opsonin)促进吞噬细菌等颗粒性抗原。由于补体对热不稳定,因此又称为热不稳定调理素(heat-labile opsonin)。抗体又称热稳定调理素(heat-stableopsonin)。补体与抗体同时发挥调理吞噬作用,称为联合调理作用。中性粒细胞、单核细胞和巨噬细胞具有高亲和力或低亲和力的FcγRI(CD64)和FcγRⅡ(CD32),IgG尤其是人IgG1和IgG3亚类对于调理吞噬起主要作用。嗜酸性粒细胞具有亲和力FcγRⅡ,IgE与相应抗原结合后可促进嗜酸性粒细胞的吞噬作用。抗体的调理机制一般认为是:①抗体在抗原颗粒和吞噬细胞之间“搭桥”,从而加强了吞噬细胞的吞噬作用;②抗体与相应颗粒性抗原结合后,改变抗原表面电荷,降低吞噬细胞与抗原之间的静电斥力;③抗体可中和某些细菌表面的抗吞噬物质如肺炎双球菌的荚膜,使吞噬细胞易于吞噬;④吞噬细胞FcR结合抗原抗体复合物,吞噬细胞可被活化。
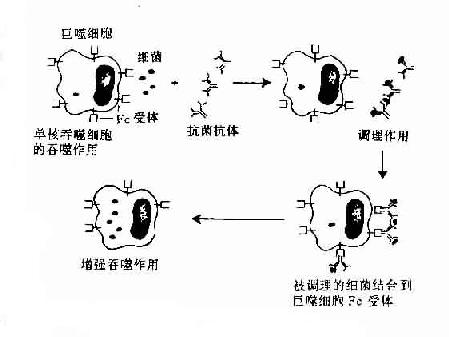
图2-9 抗体的调理吞噬作用
3.发挥抗体依赖的细胞介导的细胞毒作用 当IgG抗体与带有相应抗原的靶细胞结合后,可与有FcγR的中性粒细胞、单核细胞、巨噬细胞、NK细胞等效应细胞结合,发挥抗体依赖的细胞介导的细胞毒作用(antibodydependentcell-mediated cytotoxicity,ADCC)。目前已知。NK细胞发挥ADCC效应主要是通过其膜表面低亲和力FcγRⅢ(CD16)所介导的,IgG不仅起到连接靶细胞和效应细胞的作用,同时还刺激NK细胞合成和分泌肿瘤坏死因子和γ干扰素等细胞因子,并释放颗粒,溶解靶细胞。嗜酸性粒细胞发挥ADCC作用是通过其FcεRⅡ和FcαR介导的,嗜酸性粒细胞可脱颗粒释放碱性蛋白等,在杀伤寄生虫如蠕虫中发挥重要作用。
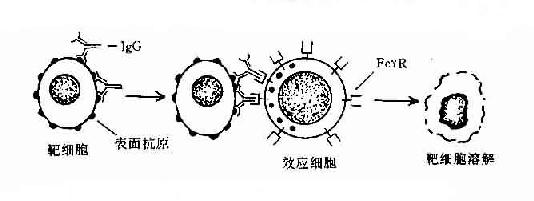
图2-10 抗体依赖的细胞介导的细胞毒作用(ADCC)
此外,人IgGFc段能非特异地与葡萄菌A蛋白(staphylococcus proteinA,SPA)结合,应用SPA可纯化IgG等抗体,或代替第二抗体用于标记技术。
(四)通过胎盘
在人类,IgG是唯一可通过胎盘从母体转移给胎儿的Ig。IgG能选择性地与胎盘母体一侧的滋养层细胞结合,转移到滋养层细胞的吞饮泡内,并主动外排到胎儿血循环中。IgG的这种功能与IgGFc片段结构有关,如切除Fc段后所剩余的Fab并不能通过胎盘。IgG通过胎盘的作用是一种重要的自然被动免疫,对于新生儿抗感染有重要作用。
三、免疫球蛋白分子的抗原性
Ig本身具有抗原性,将Ig作为免疫原免疫异种动物、同种异体或在自身体内可引起不同程度的免疫性。根据IgI不同抗原决定簇存在的不同部位以及在异种、同种异体或自体中产生免疫反应的差别,可把Ig的抗原性分为同种型、同种异型和独特型第三种不同抗原决定簇。
(一)同种型
同种型(isotype)是指同一种属内所有个体共有的Ig抗原特异性的标记,要异种体内可诱导产生相应的抗体,换句话说,同种型抗原特异性因种属(specics)而异。同种型的抗原性位于CH和CLH ,同种型主要包括Ig的类、亚类,型和亚型。
1.免疫球蛋的类和亚类(classesand subclasses)
(1)类:决定Ig不同类的抗原性差异存在于H链的恒定区(CH)。根据CH抗原性的差异(即氨基酸组成、排列、构型、二硫键等不同)H链可分为μ、γ、α、δ和ε五类,不同H链与L链组成完整Ig的分子别为IgM、IgA、IgD和IgE。在基因水平上,不同类的H链恒定区的是由不同的恒定区基因片段所编码。不同类Ig在理化性质及生物学功能上可有较大差异。
(2)亚类:同一类Ig中由于铰链区氨基酸组成和二硫键数目的差异,可分为不同的亚类,亚类间抗原性的差异要小于不同类之间的差异。目前已发现人的α重链有α1和α2两个亚类,分别与L链组成IgA1和IgA2。γ重链有4个亚类,但命名为IgG1、IgG2a、IgG2b和IgG3。IgM、IgD和IgG,目前尚未发现存在不同的亚类。Ig不同亚类也是由不同的恒定区基因片段编码。
2.免疫球蛋白的型和亚型(typesand subtypes)
(1)型:决定Ig型的抗原性差异存在于L链的恒定区(CL),根据CL抗原性的差异(氨基酸的组成、排列和构型的不同)分为κ和λ轻链之比约为2:1;而在小鼠,97%轻链为κ型,λ型只占3%左右。
(2)亚型:根据λ轻链恒定区(C2)个别氨基酸的差异又可分λ1、λ2、λ3和λ4四个亚型。λ1和λ2在λ轻链190位氨基酸的分别为亮氨酸和精氨酸,λ3和λ4在第154氨基酸分别为某氨酸和丝氨酸。
(二)同种异型
同种异型(allotype)是指同一种属不同个体间的Ig分子抗原性的不同,在同种异体间免疫可诱导免疫反应。同种异型抗原性的差别往往只有一个或几个氨基酸残基的不同,可能是由于编码Ig的结构基因发生点突变所致,并被稳定地遗传下来,因此Ig同种异型可作为一种遗传标记(genetic markers),这种标记主要分布在CH和CL上。
1.γ链上的同种异型 γ1、γ2γ3和λ4重链上均存在有同种异型标记,目前已发现:Glma、x、f、z;G2mn;G3mgl、g5、b0、b1、b3、b4、b5、c3、c5、s、t、u、v;G4m4a、4b。共20种左右。其中G表示λ链,1、2、3或4表示亚类λ1、λ2、λ3和λ4,m代表标记(marker)。
除Glmf和z位于IgG1分子的Cγ1区外,其余的Gm均位于Fc部位。一条γ链可能同时具有一个以上的Gm标志,如白种人常常在γ1H链Cγ1区有G1mz,Fc部位有G1ma。由于人第14号染色体编码四种IgG亚类的C区基因Cγ1、Cγ2、Cγ3和Cγ4是密切连锁的,因此IgGH链各亚类Gm标记可作为间倍体(haplotype)遗传给子代。
2.α链上的同种异型 α2H链已发现有A2m1和A2m2两种。A2m1在411、428、458和467位氨酸上分别为苯丙氨酸、天冬氨酸、亮氨酸、缬氨酸;A2m2则分别为苏氨酸、谷氨酸、异亮氨酸和丙氨酸。α1H链上尚未发现有同种异型存在。
3.ε链上的同种异型目前只发现Em1一种同种异型。
4.κ链上的同种异型旧称为Inv,现分为Km1、2和3。Km1在153位和191位氨基酸上分别为缬氨酸和亮氨酸,Km2分别为丙氨酸和亮氨酸,Km3分别为丙氨和缬氨酸。λ轻链上尚未发现有同种异型。
(三)独特型
独特型(idiotype)为每一种特异性IgV区上的抗原特异性。不同抗体形成细胞克隆所产生的IgV区具有与其客观存在抗体V区不同的抗原性,这是由可变区中成其是超变区的氨基酸组成、排列和构型所决定的。所以,在单一个体内所存在的独特型数量相当大,可达107以上。独特型的抗原决定簇称为独特位(idiotope),可在异种、同种异体以及自身体内诱产生相应在的抗体,称为抗独特型抗体(antiidiotypicantibody,αI d),独特型和抗独型抗体可形成复杂的免疫调节中占有得要地位。
表2-1 人免疫球蛋白分子上抗原决定簇的分类
分类 |
抗原性存在部位 |
举例 |
同种型 |
类 亚类 型 亚型 |
CH CH CL CL(λ) |
IgM、IgG、IgA、IgD、IgE IgG1-4,IgA1、2 κ、λ λ1、λ2、λ3、λ4 |
同种异型 |
CH(λ1) (λ2) (λ3) (λ4) CH(α2) CH(ε) CL(κ) |
G1ma(1)、x(2)、f(3)、z(17) G2mn(23) G3mb1(5)、c3(6)、b5(10)、b0、(11)b3(13)、b4(14)、s(15)、t(16)、g1(21)、c5(24)、u(26)、v(27)、g1(28) G4m4a(1)、4b(1) A2m1、2 Em1 Km1、2、3 |
独特型 |
VHVL |
极多 |
|
|
|
|
注:γ1~γ4同种异型的命名中,WHO1976年建议采用阿拉数字代号,但目前许多专业实验室仍沿用小写英文字母,在本表中将γ链同种异型阿拉伯数字代号列于相应英文字母代号后的括号中
四、免疫球蛋白分子的超家族
应用DNA序列分析和X晶体衍射分析等研究表明,许多细胞膜表面和机体某些蛋白质分子,其多肽链折叠方式与Ig折叠相似,在DNA水平和氨基酸序列上与IgV区或C区有较高的同源性,它们可能从同一原始祖先基因(primodial ancestral gene)经复制和突变衍生而来。编码这些多肽链的基因称为免疫球蛋白基因超家族(immunoglobulin gene superfamily),这一基因超家族所编码的产物称为免疫球蛋白超家族(immunogloblin superfamily,IGSF)。
(一)免疫球蛋白超家族的组成
由于细胞表面标记、单克隆抗体以及基因工程研究的进展,近年来发现属于IGSF的成员已达近百种,主要包括T细胞、B细胞抗原识别受体和信号传导分子,MHC及相关分子,Ig受体,某些细胞因子受体,神经系统功能相关分子,以及部分白细胞分化抗原(CD)(表2-2)。
表2-2 免疫球蛋白超家族的组成(成员举例)
主要功能 |
成员 |
抗原识别受体和信号传导分子 |
IgH链:μ、γ、δ、ε和α链 IgL链:κ和λ链 SmIg复合物成分:MG-1(Ig-α,CD79a)、B29(Ig-β,CD79b) TCR:α、β、γ和δ链 CD3:γ、δ和ε链 |
MHC及其相关分子 |
MHCⅠ类抗原:α链、β2M MHCⅡ类抗原:α、β链 β2M相关分子:CD1、Qa、TL |
免疫球蛋白受体 |
PolyIgR(pIgR) IgG Fc段受体:FcγRⅠ(CD64)、FcγRⅡ、FcγRⅢ(CD16) Ige Fc段受体:FcεRIα链 IgE Fc段受体:FcαR |
细胞因子受体 |
IL-1R(CDw121a),IL-6R(CD126),M-CSFR(CD115),G-CSFR、SCFR(CD117),PDGFR |
白细胞分化抗原 |
CD2,LFA-3(CD58),ICAM-1(CD54),ICAM-2(CD102)、ICAM-3(CD50),CD4,CD8α、β链,CD28,B7/BB1(CD80),CD7,CD22,CD33,CD48,CEA(CD66e),Thy-1(CDw90),PECAM-1(CD31),VCAM-1(CD106) |
(二)免疫球蛋白超家族的特点
1.IGSF的结构特点 IGSF的成员均含有1~7个Ig样功能区,第个Ig样功能区约含100(70~110)个氨基酸残基,功能区的二级结构是由3~5个股反平行β折叠股各自形成两个平行β片层的平面(anti-paralle β-pleated sheet),每个反平行β折叠股由5~10个氨基酸基组成,β片层内侧的疏水性氨基酸起到稳定Ig折叠的作用,大多数功能区内有一个二硫键,垂直连接两个β片层,形成二硫键的两个半胱氨酸间有55~75个氨基酸残基,使之成为一个球形结构,肽链的这种折叠方式称为免疫球蛋折叠(Ig fold)。
根据IGSF功能区中Ig折叠方式、两个半胱氨酸之间氨基酸残基的数目以及与IgV区或C区同源性的程度,IGSF功能区可分为V组、C1组和C2组。
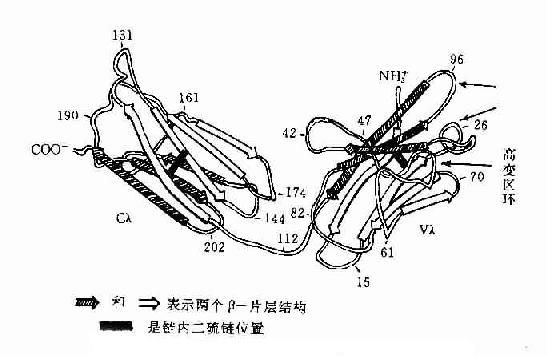
图2-11 人Ig轻链(λ)多肽折叠示意图
(1)V组:V组功能区的两个半胱氨酸之间含65~75个氨基酸残基,有9个反平行β折叠股,如IgH链和L链V区,TCRα、β、γ、δ链V区,CD4v区,CD8α、β链V区,Thy-1,pIgR和分泌成分(SC)N端四个功能区,CEAN端第一个功能区,PDGFR靠近胞膜的功能区等。
(2)C1组:又称C组。C1组功能区二个半胱氨酸之间约含50~60个氨基酸残基,有7个β折叠股,如IgH链和L链C区(γ、δ和α链的CH1~CH3或μ和ε链的CH1~CH4),TCRα、β、γ、δ链C区,MHc Ⅰ类分子重链α3功能区,β2M,MHCⅡ类分子α2和β2功能区,CD1、Qa和TL靠近胞膜功能区等。
(3)C2组:又称H组。C2组功能区的氨基酸排列的顺序类似V组,但形成二硫键的两个半胱氨酸之间所含氨基酸残基数约为50~60,有7个β折叠股,这种结构介于V组和C1组之间,如CD3γ、δ和ε链,CD2和LFA-3(CD58),pIgR靠近胞膜功能区,FcγRⅠ、FcγRⅡ、FcγRⅢ、FcεRⅠα链、FcαR,ICAM-1,CEA第2至7个功能区,IL-6R、M-CSFR、G-CSFR、SCFR。PDGFR第1至4功能区,以及N-CAM、CD22、CD48分子等。
2.IGSF功能特点 IGSF的功能是以识别为基础,因此又称为识别球蛋白超家族(cognoglobulinsuperfamily)。IGSF很可能最起源于原始的具有粘功能的基因,通过复制和突变衍生形成了识别抗原、细胞因子受体、IgFc段受体、细胞间粘附分子以及病毒受体等不同的功能区。IGSF识别的基本方式有以下几种。
(1)IGSF和IGSF相互识别:①同嗜性相互作用(heterophilicinteraction)如相同神经细胞粘附分子(N-CAM)之间的相互识别,血小板内皮细胞粘附分子-1(PECAM-1,CD31)的相互识别;②异嗜性相互作用(heterophilic interaction),如CD2与LFA-3,CD4与MHCⅡ类分子的单态部分(α2和β2),CD8与MHCⅠ类分子的单态部分(α3),poly IgR与多聚Ig,FcγRⅠ(CD64)、FcγRⅡ(CD32)、FcγRⅢ(CD16)与IgG Fc 段,FcγRⅠ与Ige Fc段,FcαR(CD89)与IgA Fc段,CD28与B7/BB1(CD80)等之间的相互识别。
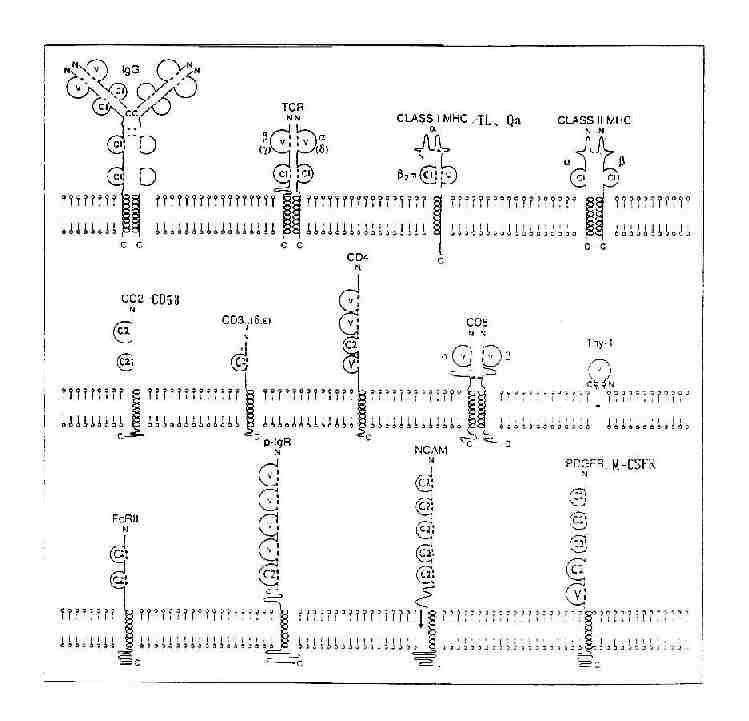
图2-12 免疫球蛋白超家族V组、C1组和C2组结构模式图
(2)IGSF和结合素(integrin)相互识别:如ICAM-1(CD54)、ICAM-2(CD102)与LFA-1(CD11a/CD18),VCAM-1(CD106)与VLA-4(CD49d/CD29)之间的相互作用。
(3)IGSF和其它分子的相互识别:包括TCR识别MHCⅠ类或Ⅱ类分子与抗原复合物,细胞因子受体识细胞因子等。
第三节各类免疫球蛋白的生物学活性
不同Ig其合成部位、合成时间、血清含量、分布、半衰期以及生物学活性有所差别。
一、IgG
IgG主要由脾、淋巴结中的浆细胞合成和分泌,以单体形式存在。在个体发育过程中机体合成IgG的年龄要晚于 IgM,在出生后第3个月开始合成,3~5岁接近成年人水平。IgG是血清中主要的抗体成分,约占血清总Ig的75%。根据IgG分子中γ链抗原性差异,人IgG有4个亚类:IgG1、IgG2、IgG3和IgG4(小鼠4个亚类是IgG1、IgG2a、IgG2b和IgG3)。其中IgG3γ3铰链区含有62个氨基酸残基,具有4个重复γ1铰链区(15个氨基酸残基)的串连结构,重链间二硫键数量多,约10~15个,因此易被蛋白酶裂解,半衰期也较短。不同IgG亚类的生物学活性有所差异(表2-3)。IgG的半衰期相对较长,约为20~30天。IgG可通过经典途径活化补体,其固定补体的能力依次是IgG3>IgG1>IgG2,在小鼠为IgG2b>IgG2a>IgG3,人的IgG4和小鼠的IgG1无固定补体的能力。IgG是唯一能通过胎盘的Ig,在自然被动免疫中起重要作用。此外IgG还具有调理吞噬、ADCC和结合SPA等作用。由于IgG上述特点,IgG在机体免疫防护中起着主要的作用,大多数抗菌、抗病毒、抗毒素抗体都属于IgG类抗体。应用对麻疹、甲型肝炎等有免疫力的产妇或正常人丙种或胎盘球蛋白可进行人工被动免疫,能有郊地预防相应的传染性疾病。不少自身抗体如抗甲状腺球蛋白抗体、系统性红斑狼疮的LE因子(抗核抗体)以及引起Ⅲ型变态反应免疫复合物中的抗体大都也属于IgG。
表2-3 人IgG不同亚类理化性质和生物学特性比较
性质 |
IgG1 |
IgG2 |
IgG3 |
IgG4 |
重链及其分子量(kD) |
γ1(52) |
γ2(52) |
γ3(58) |
γ4(52) |
单体分子量(kD) |
146 |
146 |
170 |
146 |
铰链区氨基酸数目 |
15 |
12 |
62 |
12 |
血浆中半衰期(天) |
21~23 |
21~23 |
7~8 |
21~23 |
血清浓度(mg/dl) |
800 |
400 |
80 |
40 |
固定补体 |
++ |
+ |
+++ |
- |
结合FcR:FcγRⅠ FcγRⅡ FcγRⅢ |
+++ +++ ++ |
- + - |
+++ +++ ++ |
+ + - |
结合SPA |
+ |
+ |
+ |
- |
通过胎盘 |
++ |
+ |
++ |
++ |
二、IgA
IgA主要由粘膜相关淋巴样组织产生,其中大部分是由胃肠淋巴样组织所合成,少部分由呼吸道、唾液腺和生殖道粘膜组织合成。哺乳期产妇腺组织含有大量IgA产生细胞,这些细胞主要来自胃肠。在人类,还有少量的IgA来自骨髓。人出生后4~6月开始合成IgA,4~12岁血清中含量达成人水平,血清型IgA总Ig的10%左右,半衰期约5~6天。IgA有IgA1和IgA2两个亚类。IgA1主要存在于血清中,约占血清中IgA的85%,α1链分子量为56kD;IgA2主要存在于外分泌液中,少部分以血清型IgA存在,约占血清中IgA的15%,α2链缺乏铰链区,分子量为52kD。血清中的IgA除单体形式外还有由J链共价相连的二聚体或三聚体等形式。分泌型IgA是由J连接的双体和分泌成分所组成,主要存在于初乳、唾液、泪液、胃肠液、支气管分泌等外分泌液中,是粘膜局部免疫的最重要因素,分泌型IgA通过与相应的病原微生物(如脊髓灰质炎病毒)结合,阻抑其吸附到易感细胞上,分泌型IgA还可中和毒素如霍乱弧菌毒素和大肠杆毒素等。新生儿易患呼吸道、胃肠道感染可能与IgA合成不足有关。慢性支气管炎发作与分泌型IgA的减少也有一定关系。产妇可通过初乳将分泌型IgA传递给婴儿,这也是一种重要的自然被动免疫。嗜酸性粒细胞、中性粒细胞和巨噬细胞表达FcαR,血清型单体IgA可介导调理吞噬和ADCC作用。此外,分泌型IgA具有免疫排除(immune exclusion)功能,即分泌型IgA结合饮食中大量的可溶性抗原以及肠道正常菌群或病原微生物所释放的热原物质,防止它们进入血液。
三、IgM
血清中IgM是由5个单体通过一个J链和二硫键连接成五聚体,分子量最大,为970kD,沉降系数为19S,称为巨球蛋白(macroglobulin)。在分子结构上IgM无铰链区,Cμ2可能替代了铰链区的功能。在生物进化过程中IgM是最早出现的免疫球蛋白,如八目鳗可产生IgM。在个体发育过程中,无论是B细胞膜表面Ig(SmIg),还是合成分泌到血清中的Ig,IgM都是最早出现的Ig,在胚胎发育晚期的胎儿即有能力产生IgM。在抗原刺激诱导体液免疫应答过程中,一般IgM也最先产生。IgM占血清总Ig的5%~10%。由于IgM在免疫应答早期产生,并在补体参与下的溶血作用比IgG强500倍以上,而且活化补体后通过C3B、C4b等片段发挥调理作用,因此IgM在机体的早期免疫防护中占有重要地位。天然的血型抗体(凝集素)为IgM,血型不符的输血,易发生严重的溶血反应。IgM不能过胎盘,脐血中如出现针对某种病原微生物的IgM,表示胚胎期有相应病原微生物如梅毒螺旋体、风疹或巨细胞毒等感染,称为胚胎感染或垂直感染。正常人血清中也含有产量单体IgM。
膜表面IgM是B细胞识别抗原受体中一种主要的SmIg。成熟B细胞有SmIgD,在正常人B细胞库(Bcell repretorire)中SmIgM+B细胞约占80%。在记忆B细胞中SmIgM逐渐消失,被SmIgG、SmIgA或SmIgE所替代。
四、IgD
IgD于1995年从人骨髓瘤蛋白中发现,分子量为175kD,主要由扁桃体、脾等处浆细胞产生,人血清中IgD浓度为3~40μg/ml,不到血清总Ig的1%,在个体发育中合成较晚。IgD铰链区很长,且对蛋白酶水解敏感,因此IgD半衰期很短,仅2.8天。血清中IgD确切的免疫功能尚不清楚。在B细胞分化到成熟B细胞阶段,除了表达SmIgD,抗原刺激后表现为免疫耐受。成熟B细胞活化后或者活化后或者变成记忆B细胞时,SmIgD逐渐消失。
五、IgE
IgE是1966年发现的一类Ig,分子量为188kD,血清中含量极低,仅占血清总Ig的0.002%,在个体发育中合成较晚。ε链有4个CH(Cε1~Cε4),无铰链区,含有较多的半胱氨酸和甲硫氨酸。对热敏感,56℃、30分钟可使IgE丧失生物学活性。IgE主要由鼻咽部、扁桃体、支气管、胃肠等粘膜固有层的浆细胞产生,这些部位常是变应原入侵和I型变态反应发生的场所。IgE为亲细胞抗体,Cε2和Cε3功能区可与嗜碱性粒细胞、肥大细胞膜上高亲和力FcεRⅠ结合。变应原再次进入机体与已固定在嗜碱性粒细胞、肥大细胞上IgE结合,可引起Ⅰ型变态反应。寄生虫感染或过敏反应发作时,局部的外分泌液和血清中IgE水平都明显升高。
表2-4 人各类免疫球蛋白主要的理化特性和生物学特性比较
|
IgG |
IgA |
IgM |
IgD |
IgE |
重链名称 |
γ |
α |
μ |
δ |
ε |
重链功能区数目 |
4 (Vγ、Cγ1、Cγ2、Cγ3) |
4 (Vα 、Cα1、 Cα2、Cα3) |
5 (Cμ、Cμ1、Cμ2、Cμ3、Cμ4) |
4 (Vδ、Cδ1、Cδ2、Cδ3) |
5 (Vε、Cε1、Cε2、Cε3、Cε4) |
主要存在形式 |
单体 |
单体、双体 |
五聚体 |
单体 |
单体 |
MW(Kd) |
146~170 |
160,400 |
970 |
175 |
188 |
平均含碳水化合物(%) |
4 |
10 |
12 |
18 |
12 |
成人血清浓度(mg/dl±SD) |
1150±300 |
210±50 |
150 |
0.3~4 |
0.002 |
占血清总Ig% |
75 |
10 |
5~10 |
<1 |
<0.001 |
存在于外分泌液中 |
- |
+++ |
+ |
- |
- |
经典途径活化补体 |
++(IgG> IgG>IgG2) |
- |
+++ |
- |
- |
替代途径活化补体* |
+ |
+ |
? |
+ |
+ |
结合吞噬细胞 |
++(IgG3>IgG1) |
+ |
- |
- |
+(嗜酸性粒细胞) |
结合肥大细胞和嗜碱性粒细胞 |
- |
- |
- |
- |
+++ |
结合SPA |
+ |
± |
± |
- |
- |
半衰期(天) |
20~23(IgG3)为7~8 |
5.8 |
5.1 |
2.8 |
2.5 |
合成部位 |
脾、淋观点结浆细胞 |
粘膜相关 淋巴样组织 |
脾、淋巴结、浆细胞 |
扁桃体、脾浆细胞 |
粘膜固有层浆细胞 |
开始合成时间 |
生后3月 |
4~6月 |
胚胎后期 |
较晚 |
较晚 |
达成人水平时间 |
3~5岁 |
4~12岁 |
6月~1岁 |
较晚 |
较晚 |
通过胎盘 |
+ |
- |
- |
- |
- |
免疫作用 |
抗菌、抗病毒、抗毒素,自身抗体 |
粘膜局部免疫作用,抗菌、抗病毒,免疫排除功能 |
早期防御作用,溶菌,溶血,SmIgM,天然血型抗体,类风湿因子 |
SmIgM+ SmIgD+ 正应答 |
抗寄生虫感染I型超敏反应 |
*聚合的Ig
第四节免疫球蛋白基因的结构和抗体多样性
Ig分子是由三个不连锁的Igκ、Igλ和IgH基因所编码。Igκ、Igλ和IgH基因定位于不同的染色体上(表2-5)。编码一条Ig多肽链的基因是由在胚系中多个分隔的DNA片段(基因片段)经重排而形成的。1965年Dreyer和Bennet首先提出假说,认为Ig的V区和C区是由分隔存在的基因所编码,在淋巴细胞发育过程中这两个基因发生易位而重排在一起。1976年日本学者利根川进应用DNA重组技术证实了这一假说。利根川进由此获得1987年医学和生理学诺贝尔奖。
表2-5 免疫球蛋白基因定位
编码多肽链 |
基因符号(人) |
基因染色体定位 |
人 |
小鼠 |
κ轻链 |
Igκ |
2 |
6 |
λ轻链 |
Igλ |
22 |
16 |
重链 |
IgH |
14 |
12 |
|
|
|
|
|
一、Ig重链基因的结构和重排
(一)重键V区基因
H链V区是由V、D、J三种基因片段经重排后组成。
1.H链V区基因组成
(1)V基因片段:小鼠VH基因段约为250~1000,人的VH基因片段约为100。V基因片段编码VH的信号序列和V区靠N端98个氨基酸残基,包括CDR1和CDR2。
(2)D基因片段:D是指多样性(diversity)。D基因片段仅存在于H链,不存在于L链。小鼠DH共有12个片段,人的DH片段的数目还不完全清楚,可能有10~20个左右。D片段编码H链CDR3中大部分氨基酸残基。
(3)J基因片段:J是连接(joining)的意思。JH连接V基因片段和C基因片段。小鼠JH有4个,人有9个JH片段,其中6个是有功能的。J基因片段编码CDR3的其余部分氨基酸残基和第4个骨架区。
2.H链V区基因的移位 首先发生D与J基因片段的连接形成D-J,然后V基因片段与D-J基因片段连接。H链V区基因的易位和连接是通过七聚体-间隔序列-九聚体识别信号和重组酶而完成的。
(二)重链C区基因
1.C基因片段小鼠H链区基因片从5’端到3’排列的顺序是Cμ-Cδ-Cγ3-Cγ1-Cγ2b-Cε-Cα2,人H链C区基因的顺序为Cμ-Cδ-Cγ3-Cγ1-Cε2(pseudo基因)- Cα2- Cγ2-Cγ- Cε- Cα2(图2-13,14)。
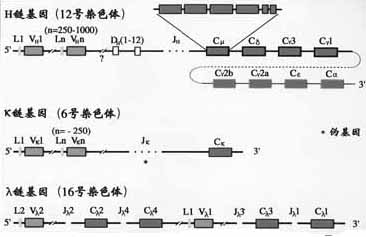
图2-13小鼠Ig基因结构
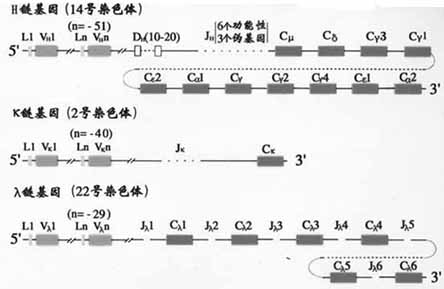
图2-14 人Ig基因结构
2.Ig类别转换(class switch) 是指一个B细胞克隆在分化过程中,V基因不变,而CH基因片段不同重排,比较CH基因片段重排后基因编码的产物,其V区相同,而C区不同,即识别抗原的特异性相同,而Ig的类或亚类发生改变。Ig可能是通过缺失模式(deletion model)和RNA剪接(splicing)两种机制来实现类别的转换。
(三)膜表面Ig重链基因
膜表面Ig(Sm Ig)是B细胞识别抗原的受体。(Sm Ig)和分泌性Ig的H链结构相类似,所不同的是smIgH名字的羧基端多含一段穿膜的疏水性氨基酸残基和胞浆区。因此SmIgH链的转录本(transcript)要比分泌性IgH链转录本多1~2个外显子。编码H链的羧基端部分,其氨基酸残基的的数目视H链不同而有差异,如在小鼠或人SmIgμ链的这一部分长约41个氨基酸残基,而小鼠SmIgε链此区域却有72个氨基酸残基。这个区域包括三个部分:①一个酸性间隔子,与H链最后一个CH功能区相同,位于胞膜外侧;②含26个氨基酸残基的疏水区,为穿膜部分;③胞浆内部分,3~28个氨基酸残基不等。
二、Ig轻链基因的结构和重排
在IgH链基因重排后,L链可变区基因片段随之发生重排。在L链中,κ链基因先发生重排,如果κ基因重排无效,随即发生λ基因的重排。L链匠CDR1、CDR2和大部分CDR3由Vκ或Vλ基因片段所编码(Vκ编码95个氨基酸残基),Jκ或Jλ基因片段编码CDR3的其余部分和第四个骨架区(Jλ编码从96位到108位氨基酸)。L链无D基因片段。
(一)κ链基因的结构和重排
κ链基因是V基因片段(Vκ)、J基因片段(Jκ)和C基因片段(Cκ)重排后组成。小鼠Vκ基因片段约有250,Jκ有5个(其中4个功能),Cκ只有1个。人Vκ基因片段约有100个,Jκ有5个。Cκ也只有1个。Vκ与Cκ之间以随机方式发生重排。
(二)λ链基因的结构和重排
κ链基因也是由Vλ、Jλ和Tλ基因片段经重排后组成。小鼠Vλ基因片段有3个:Vλ1、VλX;4个Jλ和4个Cλ基因片段,分为(Jλ2Cλ2,Jλ4Cλ和Jλ3Cλ3,Jλ1Cλ1)两组。它们的基因重排比较复杂。人Vλ约有100个,至少有6个Cλ与各自的J基因片段相连,人λ链确切的重排情况还不清楚。
三、抗体多样性的遗传学基础
机体对外界环境中种类众多抗原刺激可产生相应的特异性抗体,推算出抗体的多样性在107以上。抗体多样性主要由基因控制。
1.胚系(germ line)中众多的V、D、J基因片段 在胚系上,尚未重排的Ig基因片段数量相当多,这是生物在长期进化中形成的。表2-6例举了小鼠H链和L链重排的多样性以及H链和κ链相互随机配对所推算的多样性数目。
表2-6 小鼠Ig多样性(举例)
多肽链 |
基因片段数 |
V区基因重组方式 |
经重排的随机配对后* 推算的多样性数目 |
V |
|
J |
H链 |
1000 |
12 |
4 |
V-D-J |
4.8×104 |
4.8×107 |
κ链 |
250 |
- |
4 |
V-J |
1.0×103 |
*多样性数目不包括VDJ连接多样性、N区插入和体细胞突变所增加的多样性数目
2.VDJ连接的多样性在L链基因重排过程中V-J连接位点有一定的变异范围,例如VL基因片段3'端5个核苷酸CCTCC和JL基因片段5'端4个核苷酸GTGG连接时,总共9个核苷酸中只有6个核苷酸编码L链第95、96位氨基酸,因此可产生8种不同的连接方式。在H链基因重排过程中K-J以及V-D-J连接时都可有连接多样性的存在。
3.体细胞突变(somaticmutation)体细胞在发育过程中可发生基因突变。以长期体外培养的B细胞前体为例,每个细胞每个碱基对的突变率约为1~43×10-5,这种点突变主要发生在V基因。体细胞突变扩展了原有胚系众多基因片段重排的多样性。
4.N区的插入在IgH链基因片段重排过程中,有时可通过无模板指导的机制(nontempletdirected mechanism),在重组后D基因片段的两侧即VH-DH或DH-JH连接处额外插入称为N区的几个核苷酸。N区不是由胚系基因所编码。在N区插入前,先通过外切酶切除VH-DH或DH-JH连接处几个碱基对,然后通过末端脱氧核苷酸转移酶(terminal deoxynucleotidyl transferase,TdT)连接上N区。由于额外插入了N区,可发生移码突变(fuame shift mutation),使插入部位以及下游的密码子发生改变,从而编码不同的氨基酸,大大地增加了抗体的多样性。
5.L链H链相互随机配对 如表2-6所示,小鼠H链和κ链随机配对后推算其多样性可达4.8×107,如果再加上H链与λ链的随机配对其多样性应更多了。
第五节抗体的制备
为了研究抗体的理化性质、分子结构与功能,以及应用抗体于临床疾病的诊断、治疗及预防都需要人工制备抗体。目前,根据制备的原理和方法可分为多克隆抗体、单克隆抗体及基因工程抗体三类。
一、多克隆抗体
大多数抗原是由大分子蛋白质组成,但只是抗原上有限部位的特殊分子结构能与其相应抗体结合,称此部位为抗原决定簇(antigenic determinant)或表位(epitope)。
一种天然抗原性物质(如细菌或其分泌的外毒素以及各种组织成分等)往往具有多种不同的抗原决定簇,而每一决定簇都可刺激机体一种抗体形成细胞产生一种特异性抗体。
在机体淋巴组织内可存在千百种抗体形成细胞(即B细胞),每种抗体形成细胞只识别其相应的抗原决定簇,当受抗原刺激后可增殖分化为一种细胞群,这种由单一细胞增殖形成的细胞群体可称之为细胞克隆(clone)。同一克隆的细胞可合成和分泌在理化性质、分子结构、遗传标记以及生物学特性等方面都是完全相同的均一性抗体,亦可称之为单克隆抗体。
在早期传统的抗体制备方法是将一种天然抗原经各种途径免疫动物,由于抗原性物质具有多种抗原决定簇,故可刺激产生多种抗体形成细胞克隆,合成和分泌抗各种决定簇抗体分泌到血清或体液中,故在其血清中实际上是含多种抗体的混合物,称这种用体内免疫法所获得的免疫血清为多克隆抗体,也是第一代抗体。由于这种抗体是不均一的,无论是对抗体分子结构与功能的研究或是临床应用都受到很大限制,因此如何能获得均一性抗体成为关注的问题。
二、单克隆抗体
体内免疫法很难获得单克隆抗体(monoclonal antibody,McAb)。如能将所需要的抗体形成细胞选出并能在体外进行培养即可获得已知特异的单克隆抗体。1975年德国学者Kohler和英国学者Milstein将小鼠骨髓瘤细胞和经绵羊红细胞(sheep rue blood cell),SRBC)免疫的小鼠脾细胞在体外进行两种细胞融合,结果发现部分形成的杂交细胞既能继续在体外培养条件下生长繁殖又能分泌抗SRBC抗体,称这种杂交细胞系为杂交瘤(hybridoma)。这种杂交瘤细胞既具有骨髓瘤细胞能大量无限生长繁殖的特性,又具有抗体形成细胞合成和分泌抗体的能力。它们是由识别一种抗原决定簇的细胞克隆所产生的均一性抗体,故称之为单克隆抗体。应用杂交瘤技术可获得几乎所有抗原的单克隆抗体,只要这种抗原能引起小鼠的抗体应答。
这种用杂交瘤技术制备的单克隆抗体可视为第二代抗体。
单克隆抗体由于纯度高、特异性强、可以提高各种血清学方法检测抗原的敏感性及特异性,但单克隆抗体多为双价抗体,与抗原结合不易交联为大分子集团,故不易出现沉淀反应。单克隆抗体的应用大促进了对各种传染病和恶性肿瘤诊断的准确性。
单克隆抗体亦可与核素、各种毒素(如白喉外毒素或篦麻毒素)或药物通过化学偶联或基因重组制备成导向药物(targetting drug)用于肿瘤的治疗,是一种新型免疫治疗方法,有可能提高对肿瘤的疗效。
单克隆抗体亦可用于对各种免疫细胞及其它组织细胞表面分子的检测,这对免疫细胞的分离、鉴定及分类及研究各种膜表面分子的结构与功能都具有重要意义。
三、基因工程抗体
自1975年单克隆抗体杂交瘤技术问世以来,单克隆体在医学中被广泛地应用于痢疾的诊断及治疗。但目前绝大数单克隆抗体是鼠源的,临床重复给药时体内产生抗鼠抗体,使临床疗效减弱或消失。因此,临床应用理想的单克隆抗体应是人源的,但人-人杂交瘤技术目前尚未突破,即使研制成功,也还存在人-人杂交瘤体外传代不稳定,抗体亲合力低及产量不高等问题。目前较好的解决办未能是研制基因工程抗体,(genetically engineering antibody)以代替鼠源单克隆抗体用于临床。
基因工程抗体兴起于80年代早期。这一技术是将对Ig基因结构与功能的了解与DNA重组技术相结合,根据研究者的意图在基因水平对Ig分子进行切割、拼接或修饰,甚至是人工全合后导入受体细胞表达,产生新型抗体,也称为第三代抗体。
基因工程抗体包括嵌合抗体、重构抗体、单链抗体、单区抗体及抗体库等。其中以嵌合抗体研究的较多,也较成熟。单链抗体及单区抗体虽具有结构简单、分子小等优点但其临床应用的前景尚待证实。

