孙萌博士研究组在《ACS nano》发表酶固定化相关论文
时间:2024年09月06日 16:39 来源:
作者:
高效催化性能的酶体系在生物传感器,合成化学,生物技术,生物燃料,医学,及许多其他工业领域,已经被广泛的研究和报道。将酶与材料结合,赋予材料生物活性,并同时提高酶的性能(例如良好的催化效率,高稳定性和易于回收),是实现酶高效率催化的重要手段。近年来,高分子载体、纳米材料、微胶囊、水凝胶、介孔硅酸盐材料的应用在推动酶高效催化方面取得了重要进展。尽管如此,在构建酶催化体系领域内仍存在酶体系催化活性低、回收利用困难等问题。克服上述不利因素是异常困难的,因为长期以来,构建酶的天然三维微环境都极具挑战,上述材料都不能实现这一目标。在对酶的微环境的研究中发现,组成酶的氨基酸模块在空间的精准排列,是实现高效催化性能的关键,酶催化活性位点的微环境由这些模块的固有手性决定。虽然手性对于酶催化的三维微环境至关重要,但三维仿生手性微环境对酶的影响尚不清楚。因此,如何构筑三维手性微环境平台,并实现酶的高效催化、高稳定性、易于回收和再利用就越发重要。
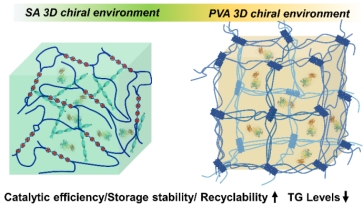
近日,受天然酶微环境启发,我院老师孙萌报道了一种具有高效催化酯类化合物水解的手性酶固定化体系,通过模拟酶的天然催化微环境,增强生物催化性能。结果表明,微环境的手性显著影响系统内固定化脂肪酶的催化效率,与非手性的微环境比,由右手螺旋纳米结构构筑的三维微环境可以提高脂肪酶的催化活性高达10倍,降低脂肪细胞甘油三酯的水平可达1.4倍。此外,该三维手性微环境还具有催化效率高、存储稳定性高、可高效回收等优点。这项工作为合理设计和构筑高效酶催化体系提供了一个有效的策略,将克服目前酶固定化在传统材料应用中的局限性,提高对生物催化的理解。
相关研究成果以“Three-Dimensional Chiral Supramolecular Microenvironment Strategy for Enhanced Biocatalysis”为题发表在ACS Nano(IF:15.881)上(https://pubs.acs.org/doi/abs/10.1021/acsnano.1c05212)。